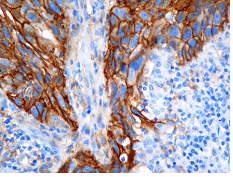
Adenocarcinoma de pulmón con expresión de PD-L1.
PD-L1 es una proteína de superficie celular que se expresa constitutivamente en las células presentadoras de antígeno (macrófagos y células dendríticas) o de forma inducida en diversos tipos celulares en respuesta a citoquinas pro-inflamatorias.
La molécula PD-L1, expresada en muchas células cancerígenas e inmunes, tiene un papel crucial en la resistencia de las células tumorales a la acción del sistema inmune del paciente. PD-L1 se une a los receptores PD1 localizados en los linfocitos T suprimiendo su migración, proliferación y acción citotóxica, evitando así que las células cancerígenas malignas sean reconocidas y eliminadas de forma eficiente.
Mediante el bloqueo de la vía PD1/PD-L1 se produce una mejora de la efectividad de las células T en el microambiente del tumor mientras tenga lugar la interacción. En base a este principio, se han diseñado diversos fármacos con la finalidad de activar el sistema inmune o volver a despertar las respuestas inmunes silenciadas mediante la supresión de la acción de los inhibidores que paralizan a las células T y crean un estado de tolerancia inmune.
Diversas publicaciones apoyan la utilización de inmunoterapia frente al cáncer. El tratamiento con anticuerpos que bloquean PD1 y PD-L1 ha sido aprobado y utilizado en clínica con resultados positivos y a menudo de larga duración. El anticuerpo monoclonal pembrolizumab ha sido aprobado por la FDA y por la Comisión Europea para el tratamiento del NSCLC avanzado, mientras que otros fármacos están siendo evaluados en ensayos clínicos.
La detección mediante immunohistoquímica del biomarcador PD-L1, cuya expresión se ha reportado en numerosos tumores de diferentes orígenes, permite la selección de pacientes susceptibles de responder a dichos tratamientos.
BIBLIOGRAFÍA
- Chen, B.J. et al. Antagonist Antibodies to PD-1 and B7-H1 (PD-L1) in the treatment of Advanced human cancer. Clin Cancer Res 2013, 19, 3462-73.
- Powles T, et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer. Nature. 2014 Nov 26;515(7528):558-62. doi: 10.1038/nature13904.
- Herbst RS, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature. 2014 Nov 26;515(7528):563-7. doi: 10.1038/nature14011.
- Tumeh PC, et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature. 2014 Nov 26;515(7528):568-71. doi: 10.1038/nature13954.
- Yadav M, et al. Predicting immunogenic tumour mutations by combining mass spectrometry and exome sequencing. Nature. 2014 Nov 26;515(7528):572-6. doi: 10.1038/nature14001.
- Gubin MM, et al. Checkpoint blockade cancer immunotherapy targets tumour-specific mutant antigens. Nature. 2014 Nov 26;515(7528):577-81. doi: 10.1038/nature13988.
- Wolchok JD, Chan TA. Cancer: Antitumour immunity gets a boost. Nature. 2014 Nov 26;515(7528):496-8. doi: 10.1038/515496a.
- Igarashi T et al. Scoring of PD-L1 expression intensity on pulmonary adenocarcinomas and the correlations with clinicopathological factors. ESMO Open. 2016 Aug 26;1(4):e000083.
- Scheel AH et al. Harmonized PD-L1 immunohistochemistry for pulmonary squamous-cell and adenocarcinomas. Mod Pathol. 2016 Oct;29(10):1165-72. doi: 10.1038/modpathol.2016.117.
- Fehrenbacher L et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet. 2016 Apr 30;387(10030):1837-46. doi: 10.1016/S0140-6736(16)00587-0
- Herbst RS et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet. 2016 Apr 9;387(10027):1540-50. doi: 10.1016/S0140-6736(15)01281-7.
02-2017 / M. Verdú