El carcinoma gástrico es, en la actualidad, una de las principales causas de morbilidad y mortalidad por cáncer y, exceptuando una pequeña proporción de pacientes diagnosticados en estadío inicial (“early gastric cancer”), se caracteriza por alta agresividad y mal pronóstico. La cirugía es el tratamiento de elección en los casos resecables, pero con altas tasas de recidiva post-quirúrgica. Por otra parte, la mayoría de pacientes se diagnostican con enfermedad avanzada y los resultados de la quimioterapia sistémica son muy limitados. La supervivencia a 5 años en USA se sitúa en el 24%.
Ensayos clínicos de reciente publicación (estudio ToGA), han demostrado respuesta significativa al tratamiento con trastuzumab en régimen combinado con quimioterapia, en los pacientes con adenocarcinoma gástrico o de unión gastroesofágica metastáticos con evidencia de amplificación/sobreexpresión del oncogen HER2, que suponen alrededor del 20% de los casos.
Trastuzumab (Herceptin®) es un anticuerpo monoclonal humanizado que bloquea la función del receptor HER2 actuando selectivamente sobre las células malignas, ampliamente utilizado en los últimos años para el cáncer de mama. En base a los resultados del estudio ToGA, se ha autorizado recientemente su empleo para el tratamiento del carcinoma gástrico.
MÉTODOS DE ESTUDIO E INDICACIÓN TERAPÉUTICA:
La inmunohistoquímica (IHQ) y la hibridación “in situ” fluorescente (FISH) son los métodos indicados para de HER2 en el carcinoma gástrico. Ambos permiten la interpretación de resultados sobre el contexto microanatómico. Con la IHQ se evalúa el grado de expresión de la proteína en la membrana celular y con FISH se evalúa el número de copias del gen en el núcleo celular para detectar su amplificación. Para el estudio de FISH es necesario disponer previamente de la IHQ con la finalidad de identificar el área de interés para una correcta evaluación de los resultados.
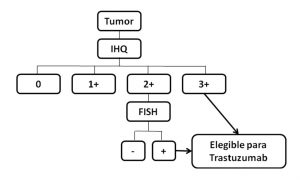
Partiendo de los resultados de los ensayos terapéuticos realizados, el algoritmo de decisión terapéutica consensuado recomienda la utilización de IHQ como test primario, puesto que se le atribuye un mayor valor predictivo de respuesta, indicando FISH sólo en los casos de positividades intermedias, no concluyentes o equívocos (2+). Los casos de alta positividad (3+) para IHQ y los casos no concluyentes (2+) para IHQ con amplificación (FISH+) se consideran candidatos a trastuzumab, mientras que los de positividad baja (1+) o nula se informan como negativos y no se consideran susceptibles de respuesta.
Este protocolo de estudio está supeditado a la fiabilidad del laboratorio que efectúa el test y vinculado a un volumen mínimo de casos anuales que acrediten su experiencia. Se precisa la formación específica del personal responsable del estudio de HER2, puesto que los criterios de evaluación difieren de los aplicados en el carcinoma de mama y, por otra parte, varían en función del tipo de muestra (biopsia o pieza quirúrgica).
CONDICIONES Y CRITERIOS DE EVALUACIÓN:
1. Condiciones pre-analíticas.
Las condiciones de manipulación y tratamiento previo de la muestra deben estar estandarizadas y deben especificarse en cada caso. El fijador idóneo es el formol neutro tamponado al 10% y el tiempo de fijación óptimo es de 6 a 48 horas, variando según el volumen de la muestra.
2. Condiciones y evaluación del estudio de HER2 mediante IHQ.
Los resultados deben evaluarse sólo en el componente tumoral y los criterios de interpretación e informe de resultados deben estar estandarizados. Se considera tinción válida la lateral y basolateral. Se establecen tres categorías (negativo, positivo, equívoco) y los criterios que determinan la exclusión del test de muestras en estado subóptimo. Quedaran excluidas de estudio las biopsias con artefactos de corte, retracción, aplastamiento y tinción de borde. También se excluirán aquellas muestras que presenten tinción granular y citoplasmática. Como controles deben utilizarse bloques de tumores con representación de las tres categorías de resultados. Si los controles no presentan los resultados esperados debe repetirse la técnica.
CRITERIOS DE EVALUACIÓN DE IHQ EN BIOPSIA GÁSTRICA:
HER2 positivo:
En IHQ consiste en positividad de membrana, lateral o basolateral, intensa y uniforme (3+) en un mínimo de 5 células neoplásicas agrupadas, independientemente del porcentaje. Esta expresión debe ser visible a 4×10 aumentos.
HER2 negativo:
En IHQ consiste en la ausencia de tinción (0) o en positividad 1+, definida como expresión focal de membrana, lateral o basolateral, en cualquier proporción de células. Esta expresión debe ser únicamente visible a 40×10 aumentos.
HER2 equívoco:
En IHQ consiste en positividad de membrana, lateral o basolateral, moderada (2+) en las células neoplásicas, independientemente del porcentaje. Esta expresión debe ser visible a 20X10 aumentos.
CRITERIOS DE EVALUACIÓN DE IHQ EN PIEZA DE GASTRECTOMÍA:
HER2 positivo:
En IHQ consiste en positividad de membrana, lateral o basolateral, intensa y uniforme (3+) en más del 10% de las células neoplásicas. Esta expresión debe ser visible a 4×10 aumentos.
HER2 negativo:
En IHQ consiste en la ausencia de tinción (0) o en positividad focal de membrana en menos del 10% de células tumorales. Así mismo, se considera negativa la positividad 1+, definida como expresión focal de membrana, lateral o basolateral, en una proporción de células superior al 10%, únicamente visible a 40×10 aumentos.
HER2 equívoco:
En IHQ consiste en positividad de membrana, lateral o basolateral, moderada (2+) en más del 10% de las células neoplásicas. Esta expresión debe ser visible a 20X10 aumentos.
3. Condiciones y evaluación del estudio de HER2 mediante FISH.
Los resultados deben evaluarse sólo en el componente tumoral y los criterios de interpretación e informe de resultados deben estar estandarizados. Se precisa realizar el estudio mediante IHQ previamente al FISH con la finalidad de identificar el área de interés para una correcta evaluación de los resultados. El cálculo del cociente HER2/CEP17 requiere el contaje en 20 células agrupadas. Debe evaluarse la cantidad y la calidad de las señales correspondientes a las sondas locus específica (HER2) y centromérica (CEP17) en el control interno de las muestras (linfocitos y células endoteliales). Si los controles no presentan los resultados esperados debe repetirse la técnica.
CRITERIOS DE EVALUACIÓN DE FISH EN CÁNCER GÁSTRICO:
HER2 positivo:
En FISH con sonda centromérica, se considera positivo un cociente HER2/CEP17 superior a 2.2, siendo CEP17 la señal centromérica del cromosoma 17.
HER2 negativo:
En FISH se considera negativo el cociente HER2/CEP17 inferior a 1.8. El porcentaje de falsos negativos debe tender al 0% y nunca superar el 5%.
HER2 equívoco:
En FISH se considera equívoco un cociente HER2/CEP17 entre 1.8 y 2.2. En este caso debe evaluarse de nuevo la muestra realizando el contaje en dos nuevos grupos de 20 células. Si el nuevo cociente HER2/CEP17 es superior o igual a 2.0 el resultado se considera positivo y si es inferior a 2.0 se considera negativo.
4. Exclusiones:
Tanto en IHQ como en FISH, se excluyen del test las muestras con deficiencias de fijación, artefactos que impiden la evaluación correcta o representación insuficiente de carcinoma.
5. Algoritmo de decisión terapéutica
Se presenta a continuación el algoritmo consensuado para la elección de pacientes susceptibles de respuesta mediante tratamiento combinado con trastuzumab. Este algoritmo está supeditado al cumplimiento de las condiciones expuestas anteriormente.
Algoritmo de HER2 en cáncer gástrico.
Bibliografía:
- Slamon DJ, Clark GM, Wong SG, et al: Human breast cancer: Correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science 235:177–182, 1987
- Slamon DJ, Leyland-Jones B, Shak S, et al: Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 344:783–792, 2001
- Piccart-Gebhart MJ, Procter M, Leyland-Jones B, et al: Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 353:1659–1672, 2005
- Gravalos C, Jimeno A: HER2 in gastric cancer: a new prognostic factor and a novel therapeutic target. Annals of Oncology 19:1523-25, 2008
- Hofman M, Stoss O, Shi D, et al: Assessment of a HER-2 scoring system for gastric cancer: results from a validation study. Histopathology 52:797–805, 2008
- Bang Y, Chung H, Xu J, et al: Pathological features of advanced gastric cancer: Relationship to human epidermal growth factor receptor 2 positivity in the global screening programme of the ToGA trial. J Clin Oncol 27:Abstract 4556, 2009
- Van Cutsem E, Kang Y-K, Chung HC, et al: Efficacy results from the ToGA trial: a phase III study of trastuzumab added to standard chemotherapy in first-line human epidermal growth factor receptor 2 (HER2)-positive advanced gastric cancer. J Clin Oncol 27:Abstract LBA4509, 2009
- Bang YJ, Van Cutsem E, Feyereislova A, et al: Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomized controlled trial. Lancet 376:687-97, 2010
www.biopat.es
M. Verdú